海外第Ⅲ相試験【ESTHER-1試験: 検証的試験】
社内資料:海外第Ⅲ相試験(ESTHER-1試験、CTD2.7.6.8)[承認時評価資料]
試験概要
- 目的
- :
- IVF/ICSIを受ける女性を対象に調節卵巣刺激の新鮮胚移植周期の継続妊娠率及び継続着床率についてレコベルのホリトロピン アルファ(遺伝子組換え(以下、ホリトロピン アルファ))に対する非劣性を検証する。
- 試験デザイン
- :
- 無作為化、実薬対照、評価者盲検、並行群間比較、国際共同、多施設共同試験
- 対象
- :
- IVF/ICSIのために調節卵巣刺激を受ける非日本人女性1326例
- 試験方法
- :
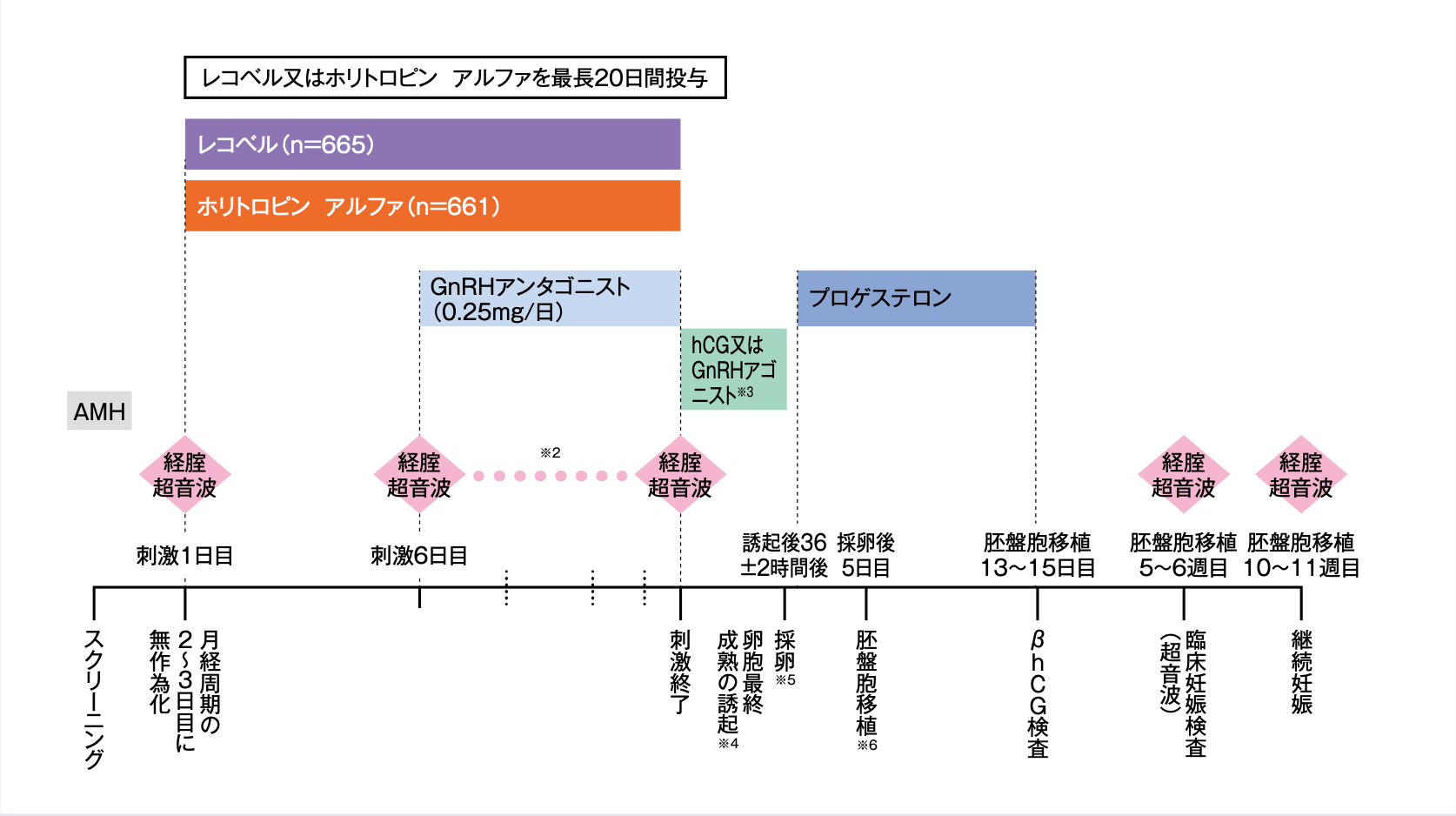
- 実施医療機関及び年齢(35歳未満、35~37歳、38~40歳)を層別因子として、月経周期の2~3日目にレコベル群又はホリトロピン アルファ群のいずれかに1:1で均等に無作為割付し、卵巣刺激を開始した。
血清AMH値が15pmol/L※1未満の被験者はレコベルの1日用量を12μgとし、15pmol/L以上の被験者は0.19~0.10μg/kgの範囲の連続変数に基づき、血清AMH値及び体重によりレコベルの1日用量を決定した。1日用量は刺激期間を通して固定し、1日最高用量は12μgとした。ホリトロピン アルファの1日用量は投与開始から刺激5日目まで150IUで固定し、以降は卵巣反応に応じて75IU単位で調節可能としたうえで最高1日用量を450IUとした(ホリトロピン アルファ150IUは11μgに相当する1))。レコベル及びホリトロピン アルファの投与期間は最長20日間とした。
併用薬の投与を含めた試験デザインを以下に示す。
- 評価項目
- :
- (1)有効性
- <主要評価項目>
-
- ・継続妊娠率※7
- ・継続着床率※8
- <副次評価項目>
-
- ・採卵数
- ・採卵数が4未満、4~7、8~14、15~19、及び20個以上であった被験者の割合
- ・AMH層別継続妊娠率 等
- (2)安全性
- <副次評価項目>
-
- ・副作用の発現割合
- ・全卵巣過剰刺激症候群※9及び/又は早期発症型卵巣過剰刺激症候群に対する予防的介入※10の発現割合 等
- 解析計画
- :
- 海外ガイドライン2、3)に従い、2つの主要評価項目(継続妊娠率及び継続着床率)について、PP解析対象集団とmITT解析対象集団を用いた解析を行った。これらの2つの集団による解析結果は同等の重要性を有することから、両解析対象集団において非劣性を検証することとした。
主解析については、全年齢層の結果を併合するため、Mantel-Haenszel法を用いて層別因子(年齢)により調整した。
各主要評価項目について、継続妊娠率及び継続着床率の投与群間の差(レコベル-ホリトロピン アルファ)の両側95%CIを算出し、対立仮説(HA)に対する帰無仮説(H0)を検定した。mITT及びPP解析対象集団ともに両側95%CIの下限値が非劣性マージンの-8.0%を上回った場合、解析対象の主要評価項目に関する帰無仮説を棄却し、両帰無仮説がいずれも棄却された場合、両主要評価項目においてレコベルのホリトロピン アルファに対する非劣性が検証されたと判断することとした。
継続妊娠率は胚移植後10~11週に子宮内生存胎児が認められた被験者の割合とし、継続着床率は、移植された胚盤胞数あたりの胚移植後10~11週に子宮内生存胎児が認められた割合とした。
主要評価項目の欠測データについては、継続妊娠に関する情報のない被験者(例:中止又は欠測データによる)は無効例とみなし、胚盤胞移植が行われたが継続着床に関する情報がない被験者(生存胎児数)も無効例(生存胎児数0)とみなした。
副次評価項目の採卵数については、血清AMH値で調整し、全被験者及び卵胞最終成熟の誘起を実施した被験者について、投与群間で比較した。
また、副次評価項目(有効性、安全性)のAMH層因子別のサブグループ解析は事前に規定されていた。 -
※1 血清AMH値のng/mLからpmol/Lへの換算式:ng/mL×7.14=pmol/L
※2:刺激1及び6日目、その後は少なくとも隔日に実施し、15mm以上の大きさの卵胞が確認された時点で、毎日来院することとした。
※3:直径が17mm以上の卵胞が3個以上みられた時点でヒト絨毛性性腺刺激ホルモン(hCG)又はGnRHアゴニストを投与し、卵胞最終成熟の誘起を行った。
※4:卵巣反応不良(刺激20日目までに直径が17mm以上の卵胞が3個以上見られない)又は卵巣反応過剰(直径12mm以上の卵胞が35個を超える)の場合には、周期を中止した。なお、直径12mm以上の卵胞が25~35個認められる場合には、GnRHアゴニストを投与してもよいこととした。
※5:採卵翌日からβhCG検査来院日まで黄体期管理のためプロゲステロン腟錠100mgを1日3回投与した(プロゲステロン腟錠の用法及び用量:プロゲステロンとして1回100mgを1日2回又は3回、採卵日(又はホルモン補充周期下での凍結胚移植ではエストロゲン投与により子宮内膜が十分な厚さになった時点)から最長10週間(又は妊娠12週まで)腟内に投与する)。
※6:採卵後5日目に最も良好な胚盤胞を移植した。なお、質の良い胚盤胞(グレード3BB以上)が得られた場合は単一胚盤胞移植、得られなかった場合は胚盤胞を2個移植した。
※7:胚移植後10~11週に少なくとも一つの子宮内生存胎児が認められるもの
※8:胚移植後10~11週の子宮内生存胎児数を、移植した胚盤胞数で除した数値
※9:早期(誘起後9日以内)及び晩期(誘起後9日を超える)発症型の卵巣過剰刺激症候群
※10:早期発症型卵巣過剰刺激症候群に対する予防的介入を以下の通り定義した。
- ・卵巣反応過剰(直径12mm以上の卵胞が25個以上認められた場合)による周期の中止
- ・GnRHアゴニストによる卵胞最終成熟の誘起(直径12mm以上の卵胞が25~35個認められた場合)
- ・ドパミンアゴニストの投与(12mm以上の卵胞が20個以上ある被験者への予防的介入としてのみ検討する)
有効性
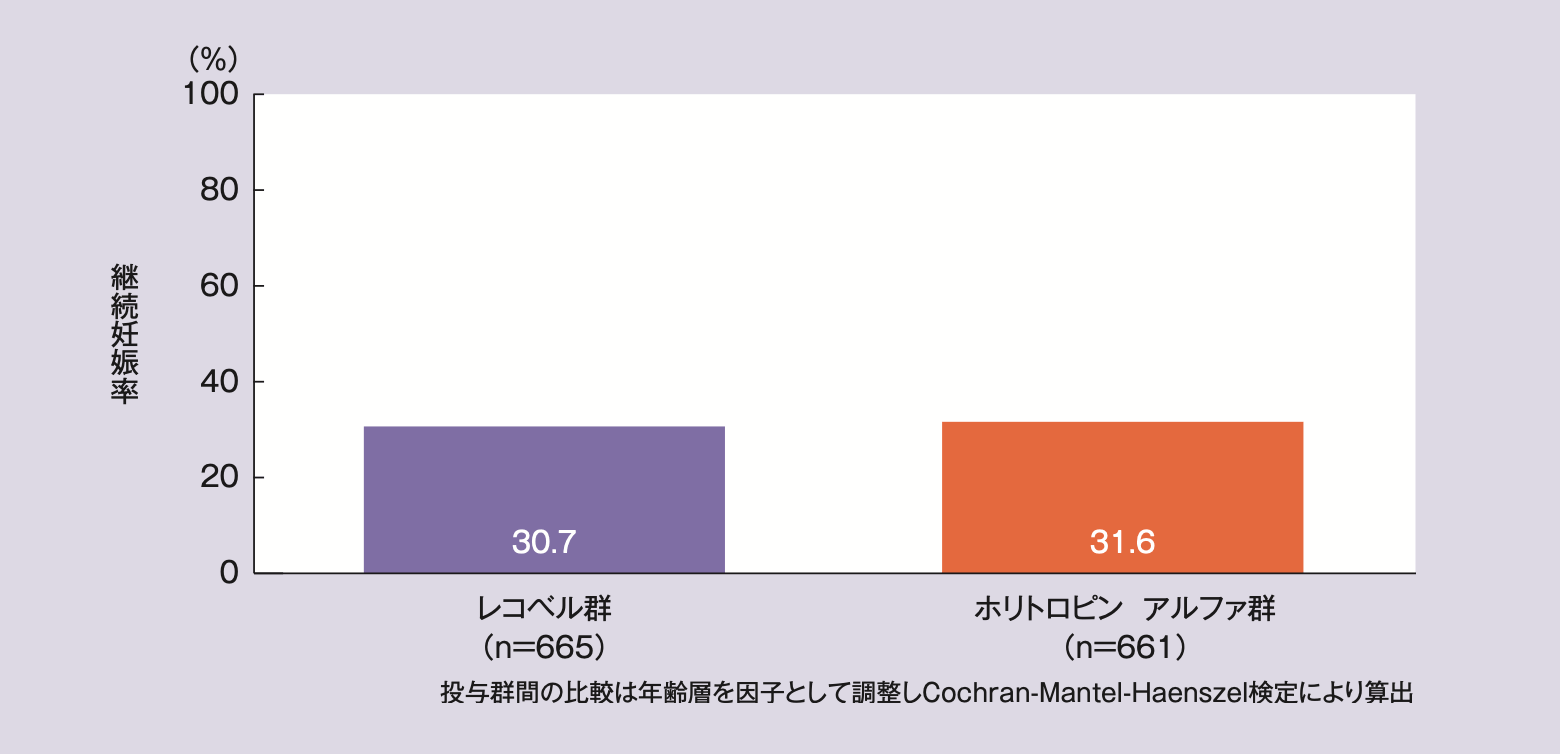
1)継続妊娠率(主要評価項目、主解析、mITT及びPP)
mITT解析対象集団の継続妊娠率はレコベル群30.7%(204/665例)、ホリトロピン アルファ群31.6%(209/661例)、群間差とその95%CIは-0.9%〔95%CI(-5.9,4.1)〕※1であった。
PP解析対象集団の継続妊娠率はレコベル群31.8%(198/623例)、ホリトロピン アルファ群32.6%(206/632例)、群間差とその95%CIは-0.9%〔95%CI(-6.0,4.3)〕※1であった。
いずれの解析対象集団においても、継続妊娠率の群間差の95%CIの下限値は、事前に規定した非劣性マージンの-8.0%を上回ったことから、レコベルのホリトロピン アルファに対する非劣性が検証された。
※1:投与群間の比較は年齢層を因子として調整しCochran-Mantel-Haenszel検定により算出
継続妊娠率(mITT解析)
2)継続着床率(主要評価項目、主解析、mITT及びPP:移植された全胚盤胞)
mITT解析対象集団の移植された全胚盤胞における継続着床率はレコベル群35.2%(206/585※2)、ホリトロピン アルファ群35.8%(209/584)、群間差とその95%CIは-0.6%〔95%CI(-6.1,4.8)〕※3であった。
PP解析対象集団の移植された全胚盤胞における継続着床率はレコベル群36.2%(200/553)、ホリトロピン アルファ群36.9%(206/558)、群間差とその95%CIは-0.9%〔95%CI(-6.5,4.7)〕※3であった。
いずれの解析対象集団においても、継続着床率の群間差の95%CIの下限値は、事前に規定した非劣性マージンの-8.0%を上回ったことから、レコベルのホリトロピン アルファに対する非劣性が検証された。
※2:子宮内生存胎児数/移植された胚盤胞数
※3:年齢層を因子として調整しCochran-Mantel-Haenszel検定により算出
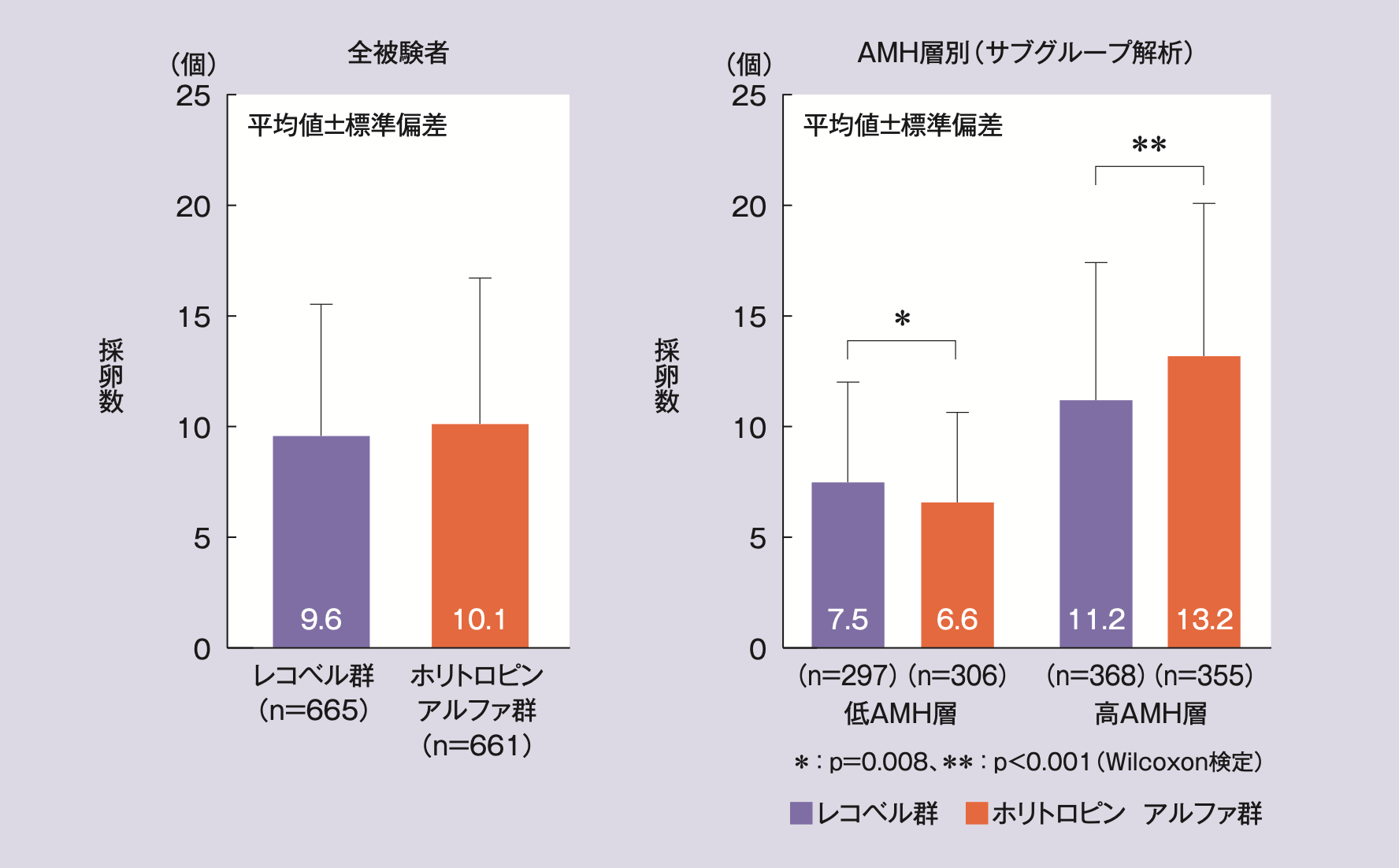
3)採卵数(副次評価項目、mITT:サブグループ解析を含む)
mITT解析対象集団の採卵数(平均値±標準偏差)は、レコベル群9.6±5.84個、ホリトロピン アルファ群10.1±6.63個であり、投与群間に統計学的な有意差はなかった(p=0.331※4)。
AMH層別にみると、低AMH層の採卵数は、レコベル群(7.5±4.57個)がホリトロピン アルファ群(6.6±4.08個)と比べ統計学的に有意に多く(p=0.008※5)、高AMH層の採卵数は、レコベル群(11.2±6.22個)がホリトロピン アルファ群(13.2±6.91個)と比べ統計学的に有意に少なかった(p<0.001※5)。
※4:血清AMH値で調整したvan Elteren検定で算出した。
※5:AMH層内のWilcoxon検定で算出した。
全被験者及びAMH層別の採卵数
4)採卵数の分布(副次評価項目、mITT:サブグループ解析を含む)
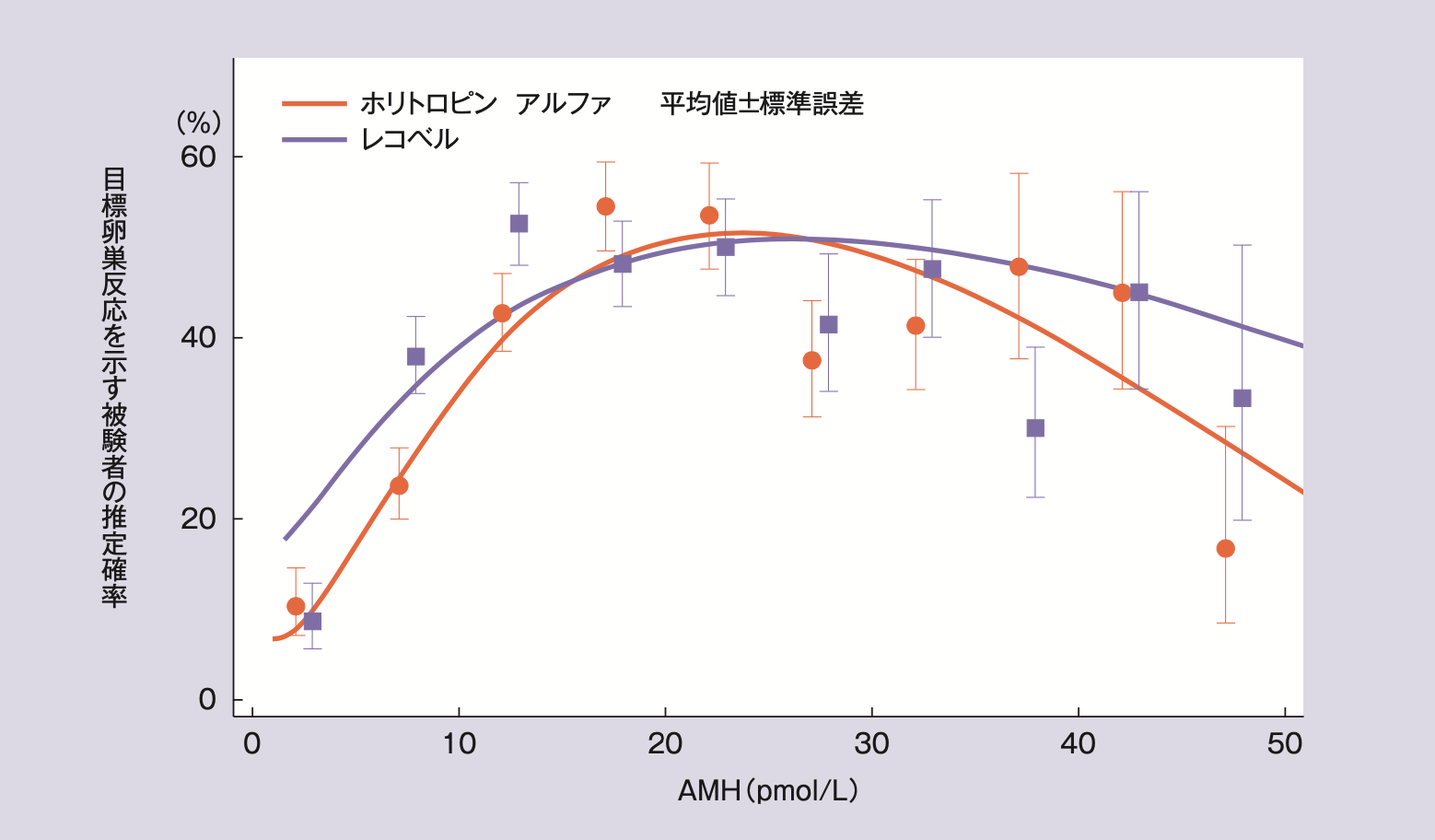
目標とする卵巣反応(採卵数8~14個)が得られた被験者の割合はレコベル群41.7%(275/660例)、ホリトロピン アルファ群37.4%(247/661例)であり、レコベル群がホリトロピン アルファ群と比べ統計学的に有意に高かった(p=0.037、ネストされたモデルの尤度比検定)。
採卵数が4個未満の被験者の割合はそれぞれ11.5%(76/660例)及び12.1%(80/661例)、4~7個の被験者の割合はそれぞれ28.9%(191/660例)及び29.5%(195/661例)、15~19個の被験者の割合はそれぞれ11.7%(77/660例)及び12.6%(83/661例)、20個以上の被験者の割合は6.2%(41/660例)及び8.5%(56/661例)であった。
スクリーニング時のAMH値別の目標とする卵巣反応(採卵数8~14個)を示す被験者の割合は以下の通りであった。
スクリーニング時のAMH別の目標卵巣反応を示す被験者の割合4)
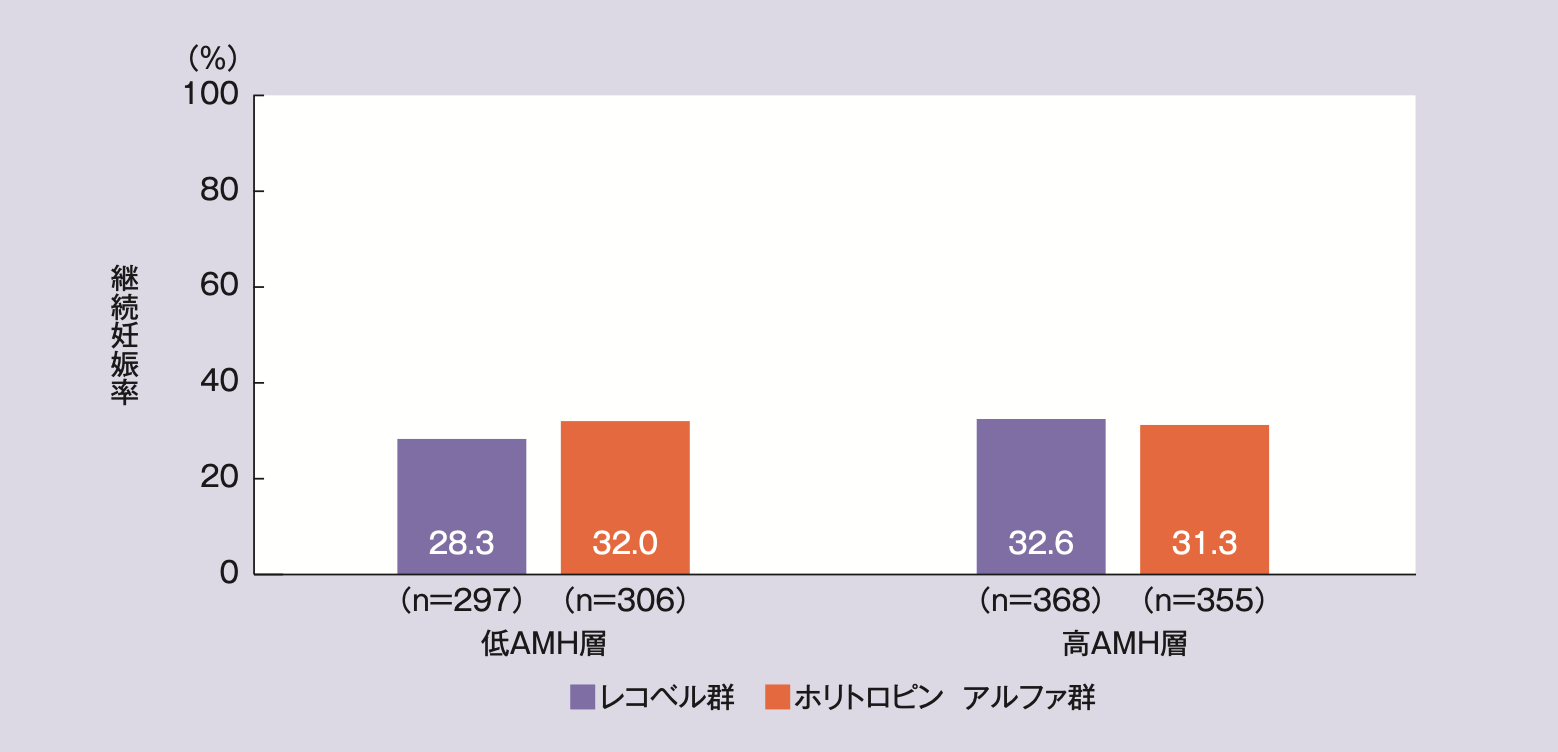
5)AMH層別継続妊娠率(副次評価項目、mITT及びPP:サブグループ解析)
mITT解析対象集団の低AMH層の継続妊娠率は、レコベル群28.3%(84/297例)、ホリトロピン アルファ群32.0%(98/306例)、高AMH層ではそれぞれ32.6%(120/368例)及び31.3%(111/355例)であった。
PP解析対象集団の低AMH層の継続妊娠率は、レコベル群29.0%(80/276例)、ホリトロピン アルファ群33.0%(96/291例)、高AMH層ではそれぞれ34.0%(118/347例)及び32.3%(110/341例)であった。
AMH層別の継続妊娠率(mITT解析)
安全性
1)副作用の発現割合(副次評価項目、安全性解析対象集団)
副作用の発現割合は、レコベル群17.0%(113/665例)、ホリトロピン アルファ群13.8%(91/661例)であった。主な副作用(いずれかの群で発現割合1%以上)は、頭痛がレコベル群5.3%(35/665例)、ホリトロピン アルファ群4.5%(30/661例)、骨盤不快感がそれぞれ3.8%(25/665例)及び3.2%(21/661例)、卵巣過剰刺激症候群がそれぞれ3.0%(20/665例)及び3.6%(24/661例)、骨盤痛がそれぞれ2.0%(13/665例)及び2.6%(17/661例)、悪心がそれぞれ1.7%(11/665例)及び1.1%(7/661例)、疲労がそれぞれ1.8%(12/665例)及び0.9%(6/661例)、子宮付属器痛がそれぞれ1.2%(8/665例)及び0.6%(4/661例)であった。
本試験で死亡例は認められず、重篤な副作用はレコベル群2例、ホリトロピン アルファ群3例に認められ、いずれも卵巣過剰刺激症候群であった。
中止に至った副作用はレコベル群6例(いずれも卵巣過剰刺激症候群)、ホリトロピン アルファ群9例(卵巣過剰刺激症候群7例、子宮内膜萎縮、卵巣機能亢進が各1例)に認められた。
2)全卵巣過剰刺激症候群及び/又は早期発症型卵巣過剰刺激症候群に対する予防的介入の発現割合(副次評価項目、安全性解析対象集団:サブグループ解析を含む)
発現した卵巣過剰刺激症候群を系統的に分類するためGolan分類を適用した(Golan分類についてはこちらを参照)。
全卵巣過剰刺激症候群はレコベル群3.5%(23/665例)、ホリトロピン アルファ群4.8%(32/661例)であった。
全卵巣過剰刺激症候群(全グレード)及び/又は早期発症型卵巣過剰刺激症候群に対する予防的介入を行った被験者の割合は、レコベル群5.6%(37/665例)、ホリトロピン アルファ群8.0%(53/661例)であった。
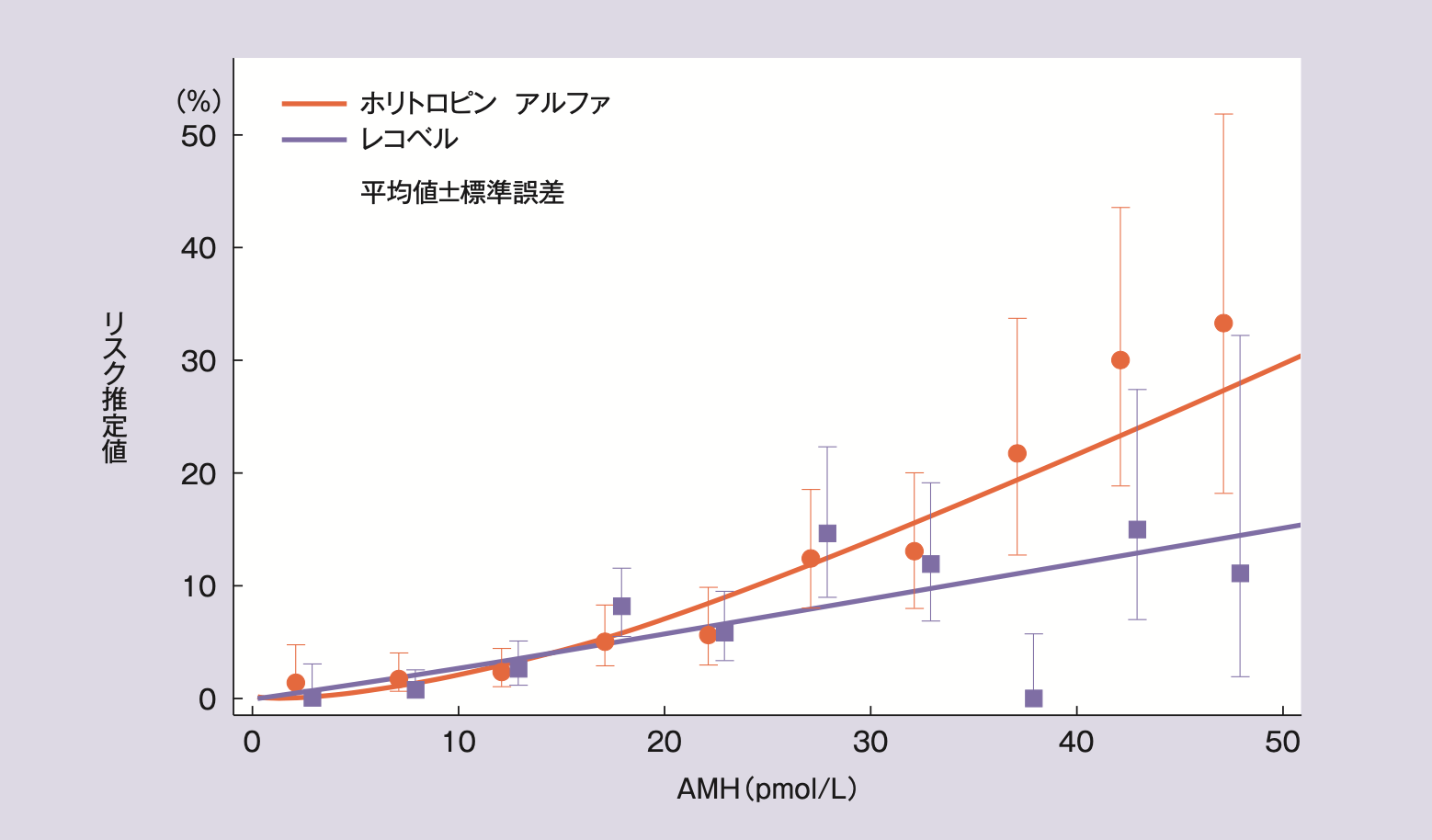
血清AMH値別全卵巣過剰刺激症候群(全グレード)及び早期発症型卵巣過剰刺激症候群に対する予防的介入のリスク推定値は以下の通りであった。
血清AMH値別全卵巣過剰刺激症候群(全グレード)及び/又は
早期発症型卵巣過剰刺激症候群に対する予防的介入のリスク推定値4)
国内における重要な基本的注意(一部抜粋)及び重大な副作用は以下のとおりである。
8. 重要な基本的注意(一部抜粋)
8.2 調節卵巣刺激をする際に卵巣への刺激が過剰になることがある。
以下の点に留意し、卵巣過剰刺激症候群の発現が予想された場合は、本剤の投与を中断し、少なくとも4日間は性交を控え、避妊するように指導すること。
- ・患者の自覚症状の有無(初期の警告的な徴候として、重度の骨盤痛、悪心及び嘔吐)
- ・急激な体重増加の有無(初期の警告的な徴候)
- ・卵巣腫大の有無(内診の他、超音波検査、血清エストラジオール値検査等)
卵巣過剰刺激症候群は本剤投与終了後に発現し、急速に(24時間から数日以内)進行して重篤化することがあるため、投与後少なくとも2週間の経過観察が必要である。多くの場合、投与後7日から10日経過した時期に最も症状が重くなる。通常、月経開始とともに自然に解消するが、妊娠した場合は、より重度になる。[1.、11.1.1参照]
11.1 重大な副作用
11.1.1 卵巣過剰刺激症候群(10.6%)
軽度又は中等度の卵巣過剰刺激症候群(10.6%)では一過性下腹部不快感、軽度悪心、嘔吐、下痢及び腹部膨満等がみられ、卵巣過剰刺激症候群の進行によって症状の持続や悪化が認められる。重度の卵巣過剰刺激症候群では、腹痛、腹部膨満、重度の卵巣腫大、体重増加、呼吸困難、乏尿、及び持続する悪心・嘔吐・下痢などの消化管症状等の症状がみられ、臨床的評価では血液量減少症、血液濃縮、電解質失調、腹水、腹膜腔出血、胸水、胸水症、呼吸困難、心囊液貯留、血栓塞栓症が認められる場合がある。重度の卵巣過剰刺激症候群(0%)では、卵巣茎捻転、卵巣破裂による卵巣出血、肺塞栓症、虚血性脳卒中、心筋梗塞、成人呼吸窮迫症候群等の合併症により重篤化することがある。重度の卵巣過剰刺激症候群が認められた場合には直ちに投与を中止し、入院させて適切な処置を行うこと。[1.、8.2参照]
1)GONAL-F. Summary of Product Characteristics.
https://www.ema.europa.eu/en/documents/product-information/gonal-f-epar-product-information_en.pdf(2021年9月時点)
2)FDA. Guidance for Industry. Non-inferiority clinical trials to establish effectiveness. November 2016.
3)ICH Harmonised Tripartite Guideline. Statistical principles for clinical trials E9. February 1998.
4)Andersen AN. et al.:Fertil Steril. 2017:107(2);387-396.
【利益相反】本研究はフェリング・ファーマ株式会社の支援により行われた。
 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。 は、
は、 会員登録がお済みでない方
会員登録がお済みでない方


