「警告・禁忌を含む使用上の注意」等は添付文書をご参照ください。
国内第Ⅱ相試験には一部承認外の用量が含まれますが、承認時評価資料のため掲載します。
国内第Ⅱ相試験(用量反応試験)
社内資料:国内第Ⅱ相試験(000124試験、CTD2.7.6.5)[承認時評価資料]
試験概要
- 目的
- :
- 調節卵巣刺激を受ける被験者において、卵巣反応に関してレコベルの用量反応性を検討する。
- 試験デザイン
- :
- 無作為化、実薬対照、評価者盲検、並行群間比較、多施設共同試験
- 対象
- :
- IVF/ICSIのための調節卵巣刺激を受ける日本人女性158例
- 試験方法
- :
- 割付け前3ヵ月以内に実施したスクリーニング時のAMH値(低AMH層:5.0~14.9pmol/L及び高AMH層15.0~44.9pmol/L※1)を層別因子として、月経周期の2~3日目に、レコベル6、9又は12μg/日群あるいは対照薬のフォリトロピンベータ(遺伝子組換え(以下、フォリトロピンベータ))150IU/日群のいずれかに1:1:1:1で均等に無作為割付した(フォリトロピンベータの1日用量150IUは15μgに相当する1))。
各群のゴナドトロピンの1日量は刺激期間を通じ固定し、1日1回腹部へ皮下注射した。卵巣反応に応じて最長16日間投与とし、卵胞最終成熟の誘起の基準に達した時点又は周期が中止された時点で投与を終了することとした。
併用薬の投与を含めた試験デザインを以下に示す。
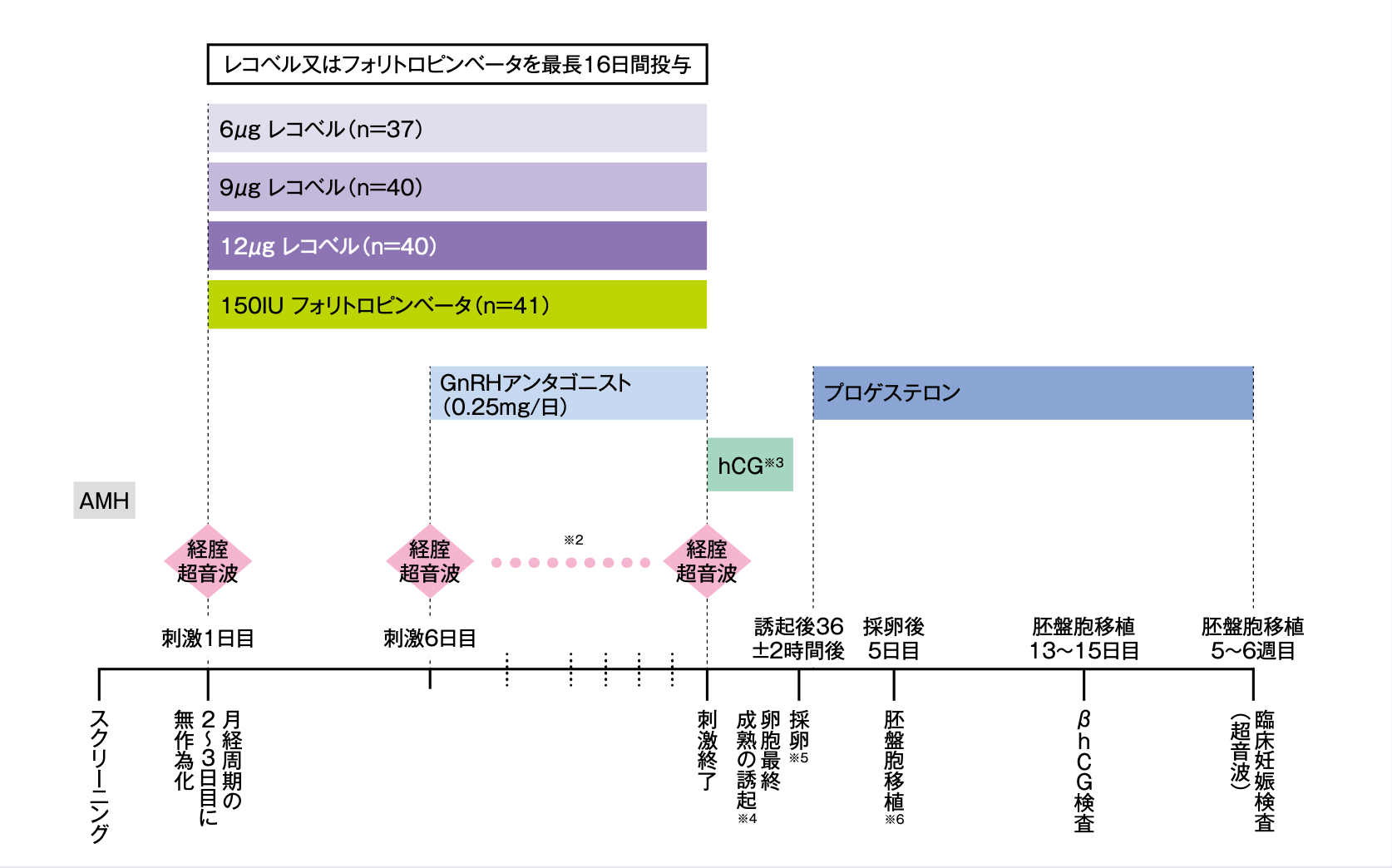
- 評価項目
- :
- (1)有効性
- <主要評価項目>
- 採卵数(分布を含む)
- <副次評価項目>
- 刺激期間中の卵胞の数及び大きさ 等
- (2)安全性
- <副次評価項目>
- 副作用の発現割合 等
- 解析計画
- :
- <主要評価項目>
採卵数を独立(転帰)変数とし、施設及びAMH層(5.0~14.9pmol/L及び15.0~44.9pmol/L)を因子とし、用量を共変量とする共分散分析(ANCOVA)を用いて分析した。主要解析は治験実施計画書に適合した対象(PP)集団、その他の解析についてはFAS解析対象集団に基づいて解析した。傾きの推定値が正であり、0とは有意に異なっている場合に、用量反応性が確立されることとした。
ANCOVAに加え、採卵数を独立(転帰)変数とし、施設及び用量を因子とする分散分析(ANOVA)を、副次解析として実施した。本モデルには全ての投与群を含み、全ての群間でのpairwise difference検定により95%信頼区間(CI)を算出した。また、AMH層因子別のサブグループ解析は事前に規定されていた。
<副次評価項目>
卵胞発育では、刺激終了時の卵胞を、卵胞ごと及び被験者ごとに投与群別に要約し、ANCOVAにより投与群間差を検討し、レコベルの用量反応性を検討した。 -
※1 血清AMH値のng/mLからpmol/Lへの換算式:ng/mL×7.14=pmol/L
※2:刺激1及び6日目、その後は少なくとも隔日に行い、15mm以上の大きさの卵胞が3個確認された時点で、被験者は毎日来院することとした。
※3:直径が17mm以上の卵胞が3個以上みられた時点で尿由来ヒト絨毛性性腺刺激ホルモン(hCG)5000IUを投与し、卵胞最終成熟の誘起を行った。
※4:刺激10日目に卵巣反応不良(直径10mm以上の卵胞が3個未満)又は卵巣反応過剰(直径12mm以上の卵胞が25個以上)の場合には、周期を中止した。なお、直径12mm以上の卵胞が25~35個認められる場合はGnRHアゴニストを投与してもよいこととし、それらの被験者は新鮮胚移植周期では移植は行わず、胚盤胞を凍結した。
※5:胚移植が予定されている被験者を対象に、黄体期管理のため採卵翌日から臨床妊娠の検査来院日までプロゲステロン腟錠100mgを1日3回投与した(プロゲステロン腟錠の用法及び用量:プロゲステロンとして1回100mgを1日2回又は3回、採卵日(又はホルモン補充周期下での凍結胚移植ではエストロゲン投与により子宮内膜が十分な厚さになった時点)から最長10週間(又は妊娠12週まで)腟内に投与する)。
※6:IVF/ICSIにより受精させた最も良好な胚盤胞1個を移植し、残りの胚盤胞は凍結した。
6. 用法及び用量
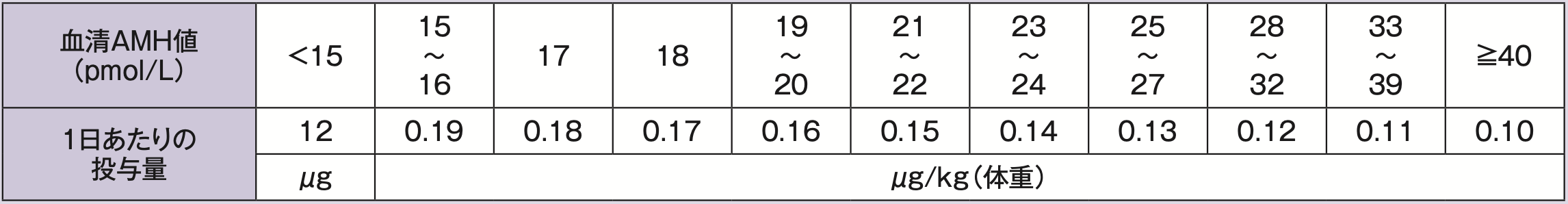
通常、ホリトロピン デルタ(遺伝子組換え)として、投与開始前の血清抗ミュラー管ホルモン(AMH)値及び体重に基づき、下表に従い算出した投与量を、月経周期2日目又は3日目から1日1回皮下投与し、卵胞が十分に発育するまで継続する。なお、下表に従い算出した投与量が6μgを下回る場合は6μgを、12μgを上回る場合は12μgを、1日あたりの投与量とする。
有効性
1)採卵数(主要評価項目)
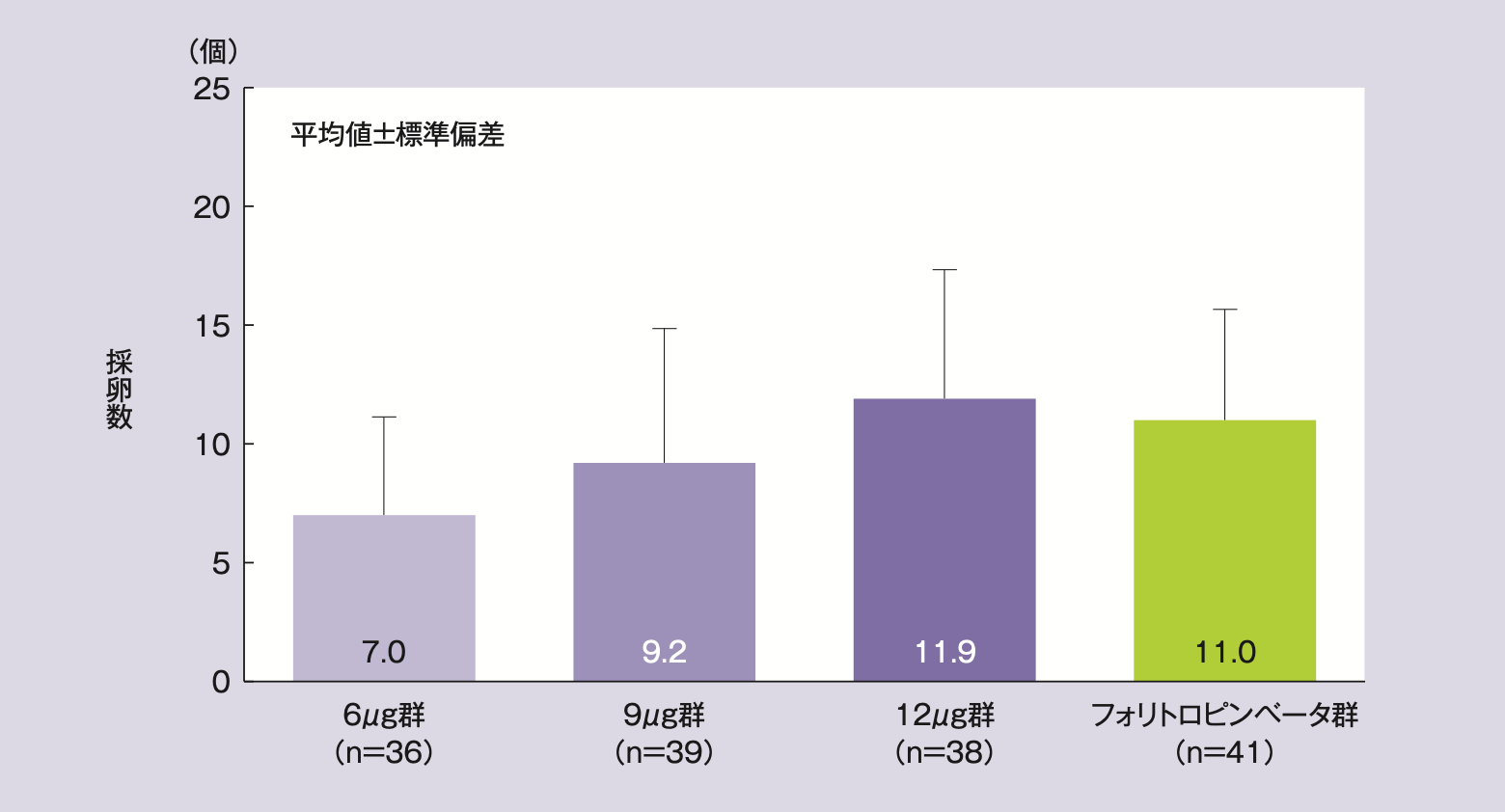
採卵数(PP:サブグループ解析を含む)
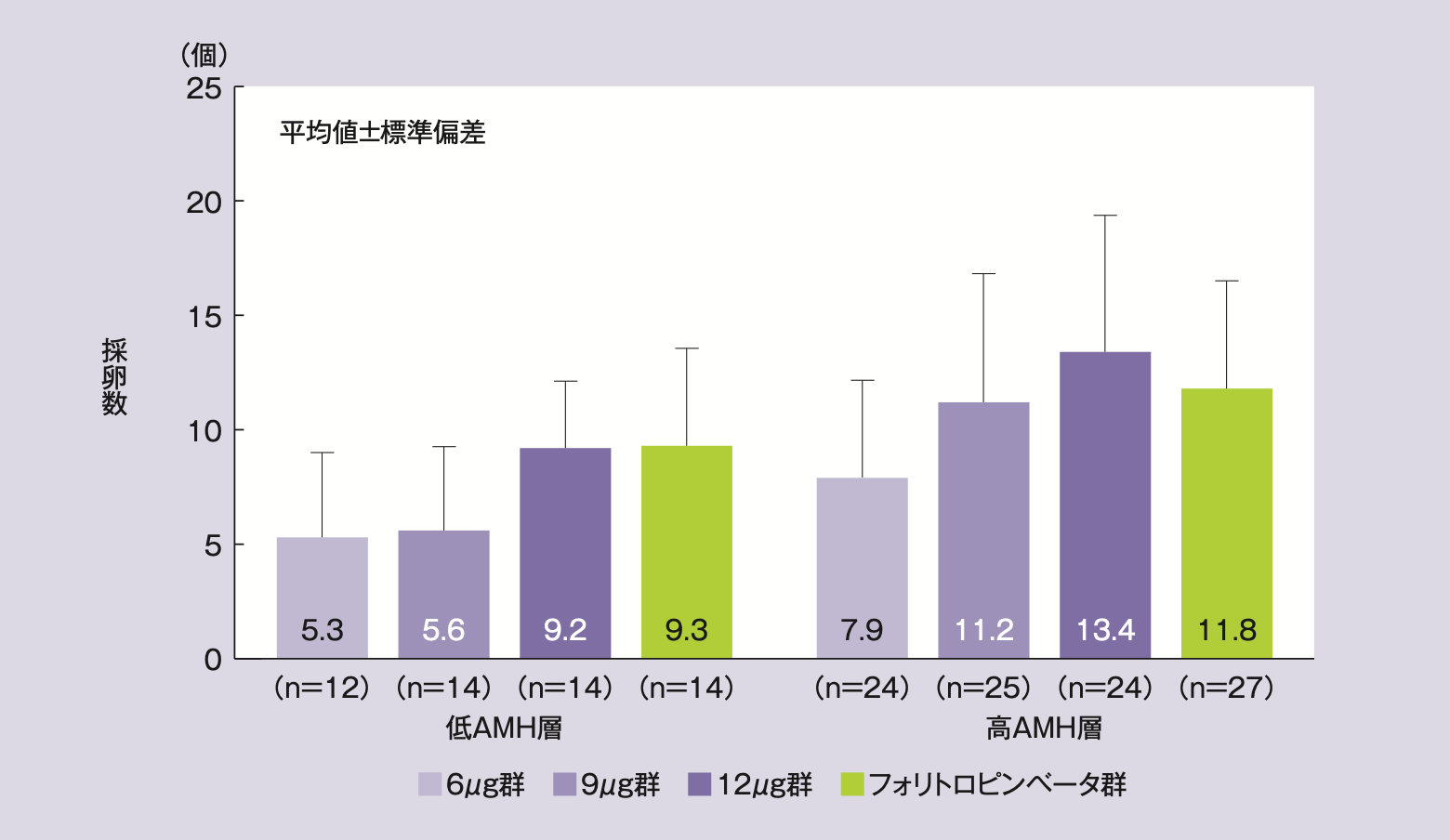
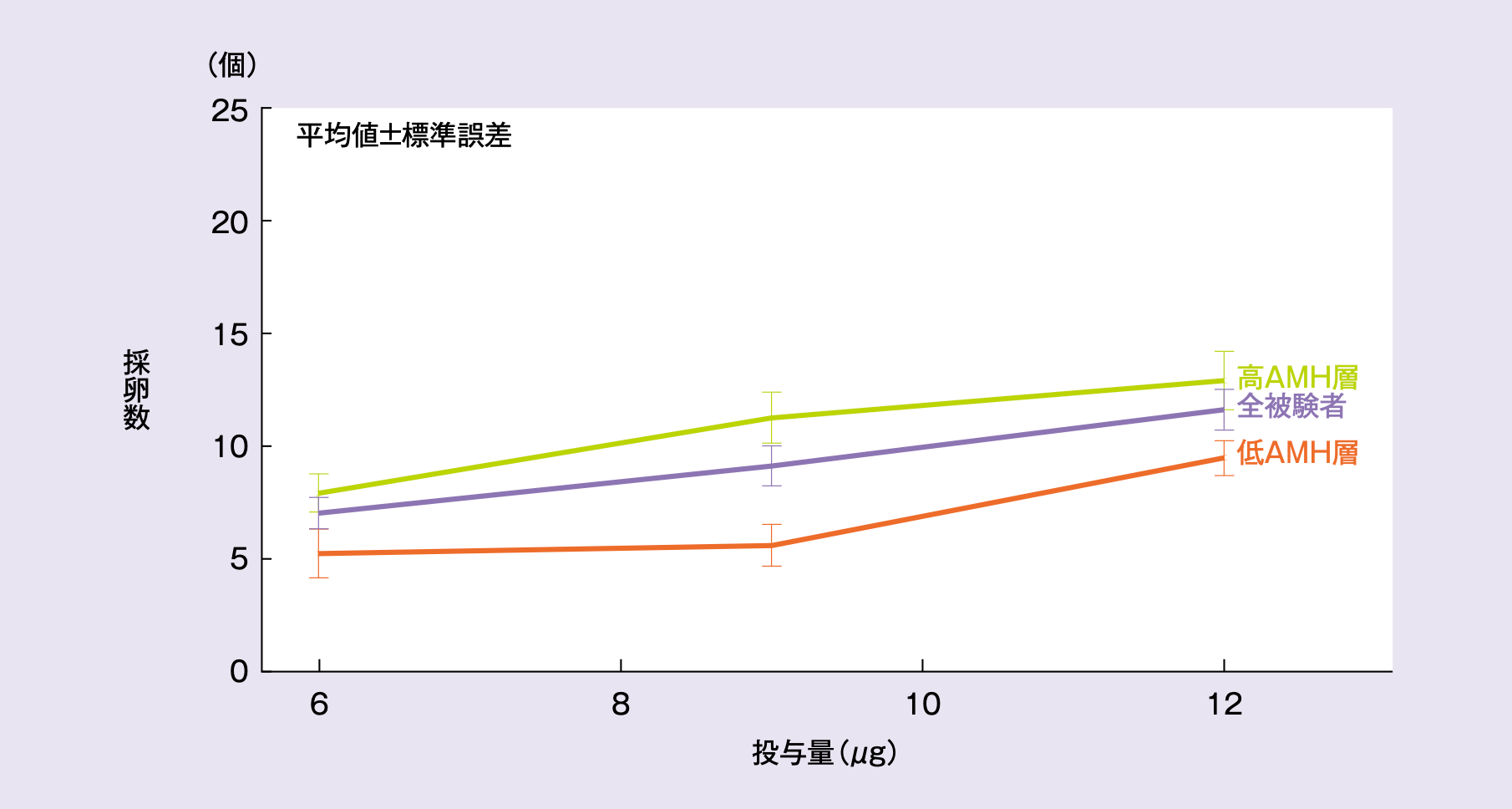
平均採卵数(平均値±標準偏差)は、レコベル6μg群7.0±4.1個、9μg群9.2±5.7個、12μg群11.9±5.4個、フォリトロピンベータ群11.0±4.7個であった。AMH層別のサブグループ解析では、レコベル群の高AMH層で7.9~13.4個、低AMH層で5.3~9.2個の範囲であり、フォリトロピンベータ群は高AMH層で11.8個、低AMH層で9.3個であった。
全被験者の採卵数
AMH層別の採卵数(サブグループ解析)
用量反応関係(PP及びFAS:サブグループ解析を含む)
PP解析対象集団において、ANCOVAモデルによる用量反応関係の傾きの推定値は0から有意に正であり、レコベル6~12μg投与時の平均採卵数に統計学的に有意な用量反応関係が認められた(p<0.001※)。
AMH層のサブグループ解析においても用量反応関係が認められた(高AMH層p<0.001※、低AMH層p=0.008※)。
※:採卵数を独立(転帰)変数、施設及びAMH層を因子とし、用量を共変量としたANCOVA
FAS解析対象集団におけるレコベルと平均採卵数の用量反応曲線は以下の通りであり、レコベルの用量が同じ場合、採卵数は低AMH層と比べ高AMH層で36~100%高かった。
レコベルと平均採卵数の用量反応曲線(FAS)
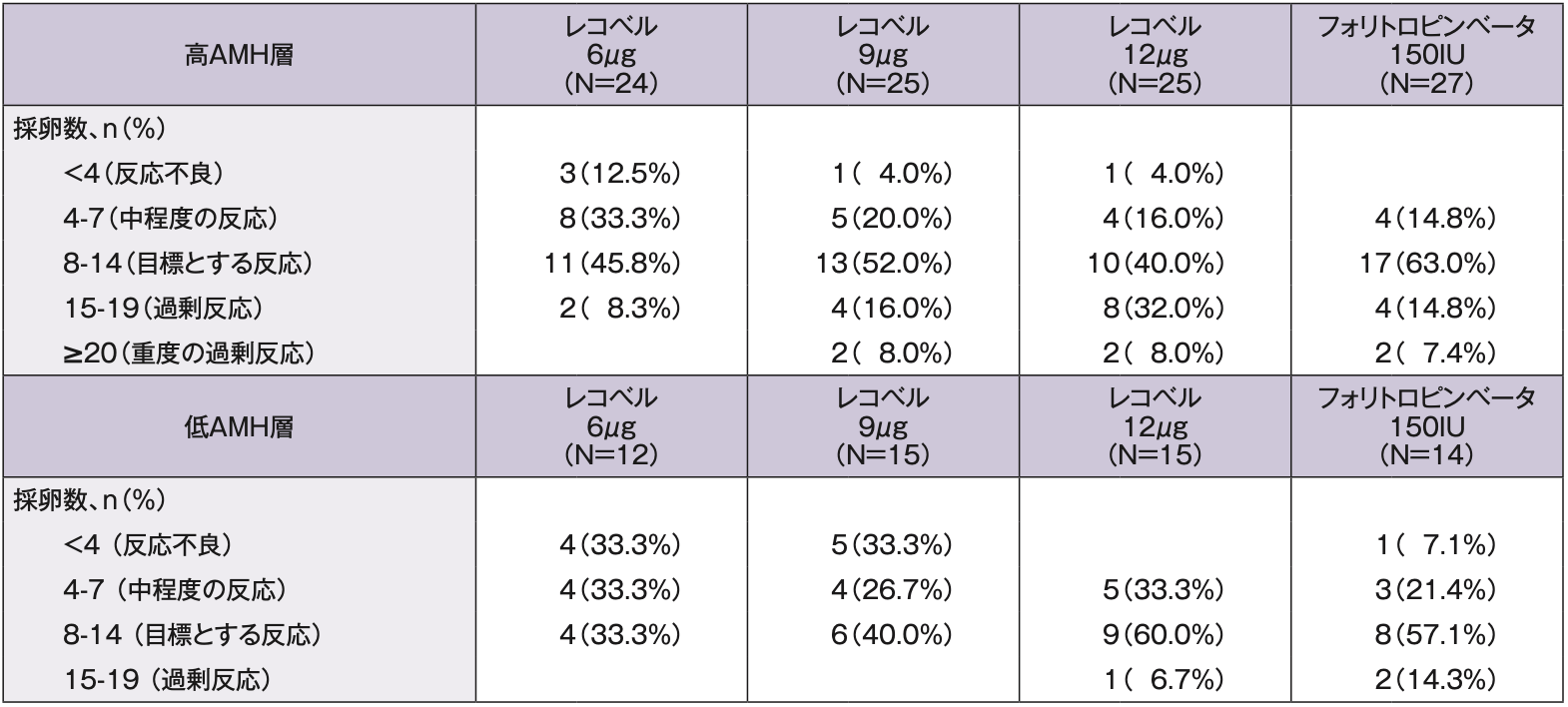
採卵数の分布(FAS:サブグループ解析)
高AMH層では、採卵数が8~14個の被験者の割合は、6、9及び12μg群でそれぞれ45.8%、52.0%及び40.0%であった。採卵数が8個未満の被験者の割合はそれぞれ45.8%、24.0%及び20.0%であった。採卵数が15個以上の被験者の割合はそれぞれ8.3%、24.0%及び40.0%であった。フォリトロピンベータ群では、採卵数が8~14個の被験者の割合は63.0%、15個以上の被験者の割合は22.2%であった。
低AMH層では、採卵数が8~14個の被験者の割合は、6、9及び12μg群でそれぞれ33.3%、40.0%及び60.0%であった。採卵数が8個未満の被験者の割合はそれぞれ66.6%、60.0%及び33.3%、採卵数が15個以上の被験者は12μg群6.7%であった。
フォリトロピンベータ群では、採卵数が8~14個の被験者の割合は57.1%、8個未満の被験者の割合は28.5%、採卵数が15個以上の被験者は14.3%であった。
AMH層別の採卵数の分布
安全性
副作用の発現割合(副次評価項目、安全性解析対象集団)
副作用の発現割合は、レコベル6μg群16.2%(6/37例)、9μg群15.0%(6/40例)、12μg群35.0%(14/40例)、フォリトロピンベータ群34.1%(14/41例)であった。
主な副作用は卵巣過剰刺激症候群が6μg群10.8%(4/37例)、9μg群7.5%(3/40例)、12μg群17.5%(7/40例)、フォリトロピンベータ群22.0%(9/41例)、卵巣腫大がそれぞれ5.4%(2/37例)、7.5%(3/40例)、7.5%(3/40例)及び2.4%(1/40例)であった。
死亡例は認められず、重篤な有害事象は9μg群で1例(子宮頚部出血)、フォリトロピンベータ群で2例(異所性妊娠、腹膜炎が各1例)に認められ、いずれも治験担当医師により治験薬との因果関係は否定された。
中止に至った有害事象は6μg群で4例(いずれも卵巣過剰刺激症候群)、9μg群2例(いずれも卵巣過剰刺激症候群)、12μg群6例(卵巣過剰刺激症候群3例、プロゲステロン増加3例)、フォリトロピンベータ群5例(いずれも卵巣過剰刺激症候群)に認められた。
1)PUREGON. Summary of Product Characteristics.
https://www.ema.europa.eu/en/documents/product-information/puregon-epar-product-information_en.pdf(2021年9月時点)
 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。 は、
は、 会員登録がお済みでない方
会員登録がお済みでない方


