男性患者国内第Ⅲ相試験1,2)(検証試験)
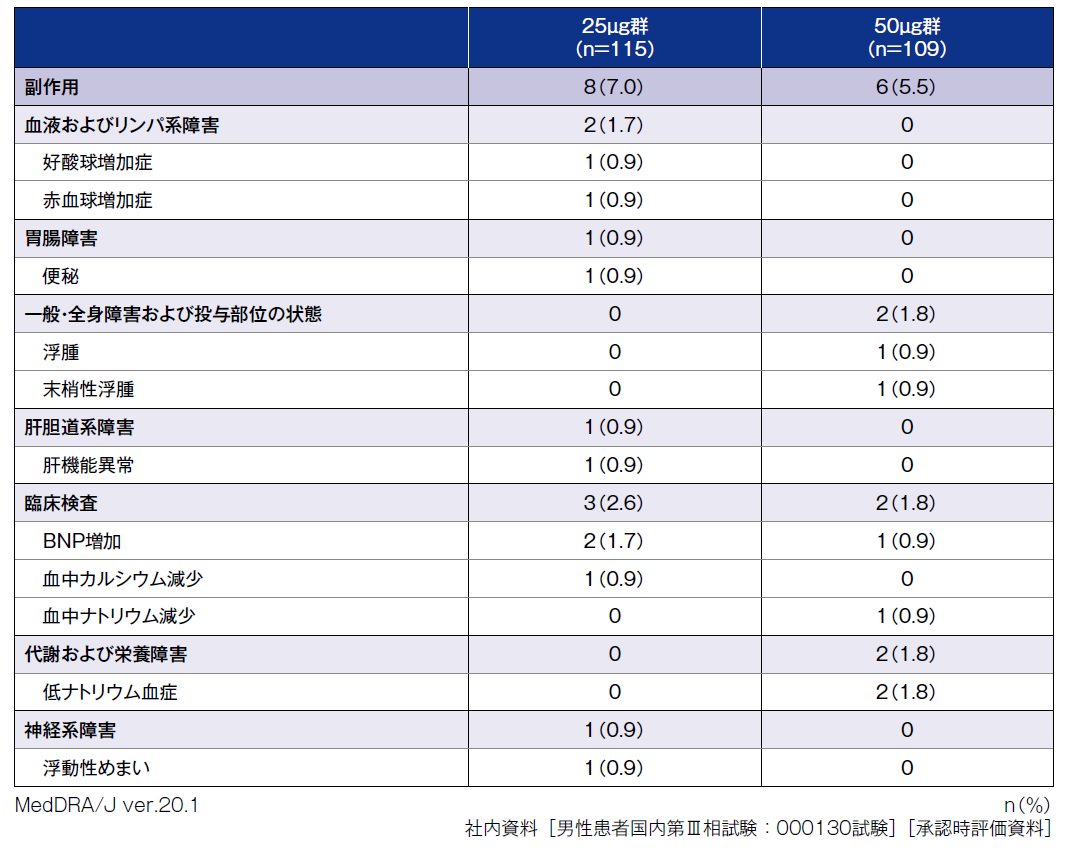
本試験における副作用の発現割合は、ミニリンメルト®50μg群5.5%(6/109例)、25μg群7.0%(8/115例)、プラセボ群6.0%(7/117例)であった。主な副作用は、ミニリンメルト®50μg群で低ナトリウム血症1.8%(2例)、25μg群でBNP増加1.7%(2例)であった。プラセボ群では、副作用として動悸、頻脈、消化不良、倦怠感、アルコール性肝疾患、BNP増加、血圧上昇が各0.9%(1例)に認められた。
中止に至った副作用は、ミニリンメルト®50μg群では低ナトリウム血症1例、25μg群では血中カルシウム減少、肝機能異常がそれぞれ1例であった。
重篤な有害事象は、ミニリンメルト®50μg群で麻痺性イレウスが1例、25μg群で膵癌が1例認められたが治験薬との因果関係は否定された。本試験において死亡例は認められなかった。
副作用一覧
6. 用法及び用量 成人男性には、通常、1日1回就寝前にデスモプレシンとして50μgを経口投与する。
7. 用法及び用量に関連する注意(抜粋)
7.1 年齢、体重、血清ナトリウム値、心機能等の状態から低ナトリウム血症を発現しやすいと考えられる場合には、デスモプレシンとして25μgから投与を開始することを考慮すること。
試験概要
目的
夜間多尿による夜間頻尿の男性患者に対しミニリンメルト®50μgまたは25μgを12週間投与したときの有効性及び安全性をプラセボを対照として検討する。
対象
成人男性夜間頻尿※1患者342例 [最大の解析対象集団(FAS)※2:338例、安全性解析対象集団※3:341例]
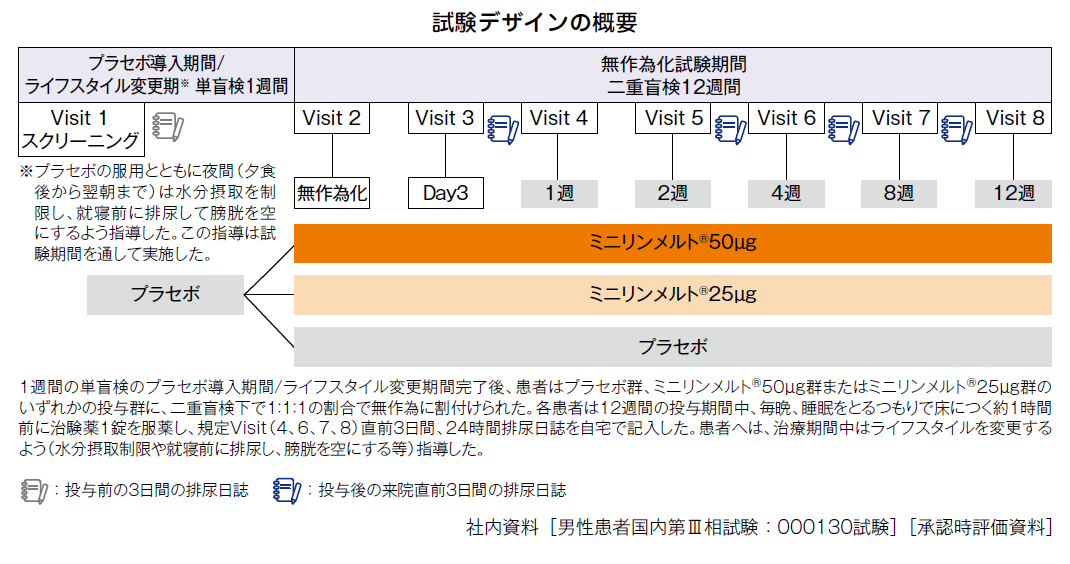
試験デザイン
多施設共同、無作為化、プラセボ対照、二重盲検比較試験
投与方法
ミニリンメルト®50μgまたは25μgまたはプラセボを毎晩、睡眠をとるつもりで床につく約1時間前に舌下・水なしで12週間投与
主要評価項目
投与12週間の平均夜間排尿回数におけるベースラインからの変化量
副次評価項目
- 投与後1、4、8、12週時点の平均夜間排尿回数におけるベースラインからの変化量
- 投与12週間及び投与後1、4、8、12週時点の就眠後第一排尿までの平均時間におけるベースラインからの変化量
- 投与12週間及び投与後1、4、8、12週時点の平均夜間尿量におけるベースラインからの変化量 等
探索的評価項目
投与12週間に一晩当たりの平均夜間排尿回数が1回以下に減少した患者の割合、投与12週間に夜間排尿回数が1回以下となった夜の割合、投与12週間に就眠後第一排尿までの時間が180分、240分、270分に至った患者の割合
解析計画
主要評価項目:3日間の排尿日誌から得られたデータを基に、ベースラインの夜間排尿回数を共変量、投与群、Visit、年齢層、投与群とVisitの交互作用※4を固定効果とする反復測定の共分散分析(ANCOVA)により解析。閉手順を用い、ミニリンメルト®50μgがプラセボに対し優位性(有意水準5%)が示された場合にのみ25μgの優位性を検定した。
副次評価項目:主要評価項目と同様のANCOVAモデルにより解析した。
探索的評価項目:臨床的に意味のある一定以上の効果を認めた患者(レスポンダーの割合:一晩当たりの平均夜間排尿回数が1回以下に減少した患者の割合、夜間排尿回数が1回以下となった夜の割合、就眠後第一排尿までの時間が180分、240分、270分に至った患者の割合)を用いたレスポンダー解析を事前に計画した。
※1 一晩当たりの夜間排尿回数2回以上及び夜間多尿指数33%以上。重症の過活動膀胱の症状が認められる患者〔過活動膀胱症状質問票(OABSS)12点以上〕、低膀胱容量(1回の最大排尿量が150mL未満)の患者等は除外。
※2 ベースライン後に、平均夜間排尿回数の測定がなかった1例、二重登録3例を除く、すべての患者集団
※3 治験薬が少なくとも1回投与され、かつ安全性評価が少なくとも1回行われたすべての患者集団
※4 投与群とVisitの交互作用の項が有意でない場合は、モデルには含めなかった。
1)社内資料[男性患者国内第Ⅲ相試験:000130試験][承認時評価資料]
2)Yamaguchi O, et al. Lower Urinary Tract Symptoms 2020: 12(1); 8-19. COI:フェリング・ファーマ実施治験

 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。 は、
は、 会員登録がお済みでない方
会員登録がお済みでない方