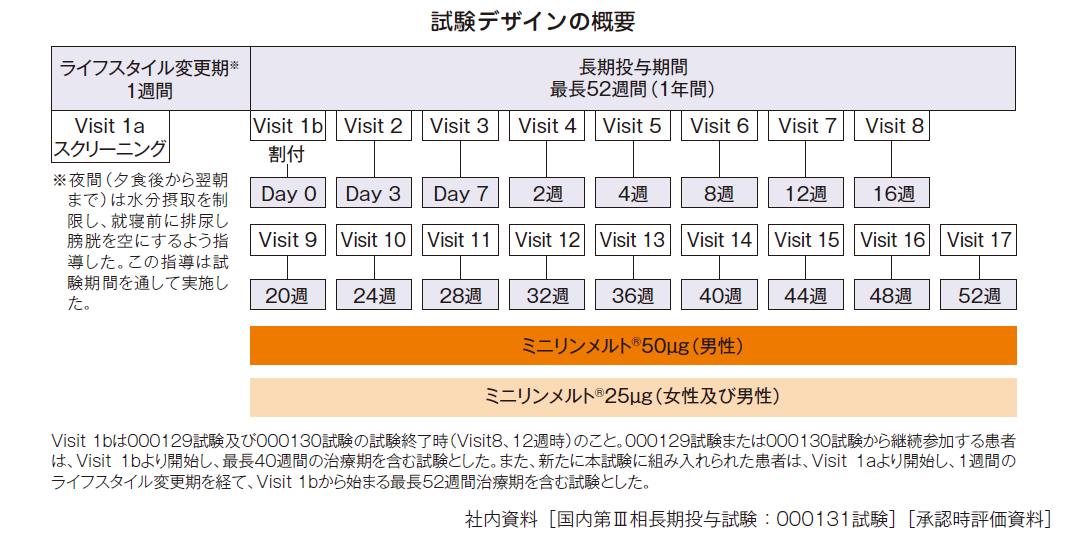
国内第Ⅲ相長期投与試験1)(000131試験)
試験概要
目的
夜間多尿による夜間頻尿の患者に対し、ミニリンメルト®を最長1年間長期投与したときの安全性及び忍容性を評価する。
対象
先行して実施した国内第Ⅲ相試験〔000129試験(女性患者を対象とした国内第Ⅲ相試験)または000130試験〕を完了した夜間頻尿患者〔000129試験(女性)から150例、000130試験(男性)から263例が移行〕及び新たに組み入れられた夜間頻尿患者※1(男女それぞれ45例)503例[併合安全性解析対象集団※2:579例、プラセボ群※3:215例、併合FAS※4:388例]
試験デザイン
多施設共同試験
投与方法
000130試験を完了した男性患者のうち、ミニリンメルト®50μgまたは25μgが投与されていた患者は、それぞれを継続し、プラセボが投与されていた男性患者は、1:1の割合で再無作為割付けを行い、ミニリンメルト®50μgまたは25μgのいずれかを投与することとした000129試験を完了した女性患者のうち、ミニリンメルト®25μgが投与されていた患者はそれを継続し、プラセボが投与されていた女性患者はミニリンメルト®25μgに切替えて投与した。治験薬は、就寝約1時間前に舌下・水なしで最長40週間投与した。新規に組み入れられた男性患者にはミニリンメルト®50μgを、女性患者にはミニリンメルト®25μgを就寝約1時間前に舌下・水なしで最長52週間投与した。
主要評価項目
安全性(有害事象の発現頻度及び重症度等)、血清ナトリウム値の測定による低ナトリウム血症の発現割合及び重症度 等
副次評価項目
投与後12、24、40及び52週時点の平均夜間排尿回数・就眠後第一排尿までの平均時間・平均夜間尿量におけるベースラインからの変化量 等
解析計画
主要評価項目※5:有害事象、バイタルサイン、血液生化学的検査、血液学的検査、尿検査及び身体所見により評価した。性別及び年齢層別(65歳未満・65歳以上)でも実施した。
副次評価項目※5:3日間の排尿日誌に基づいて記述統計量を用いて解析し、治療群、性別及び期間別に評価した(有意差検定は行っていない)。
※1 一晩当たりの夜間排尿回数が2回以上及び夜間多尿指数33%以上。重症の過活動膀胱の症状が認められる患者〔過活動膀胱症状質問票(OABSS)12点以上〕などは除外
※2 000129、000130、000131試験でミニリンメルト®を投与され、かつ安全性評価を1回以上された患者集団
※3 000129、000130試験でプラセボ群であった患者。000131試験ではミニリンメルト®50μg群または25μg群へ移行
※4 000129、000130試験でミニリンメルト®を投与され1回以上の平均夜間排尿回数の測定が行われている患者及び000131試験の新規組み入れ患者のうちベースライン後1回以上の平均夜間排尿回数の測定が行われた患者集団
※5 本試験は主に000129、000130試験から移行した患者からなる長期投与試験であることから、主要評価項目、副次評価項目について000129、000130試験も含めた併合解析を行った。
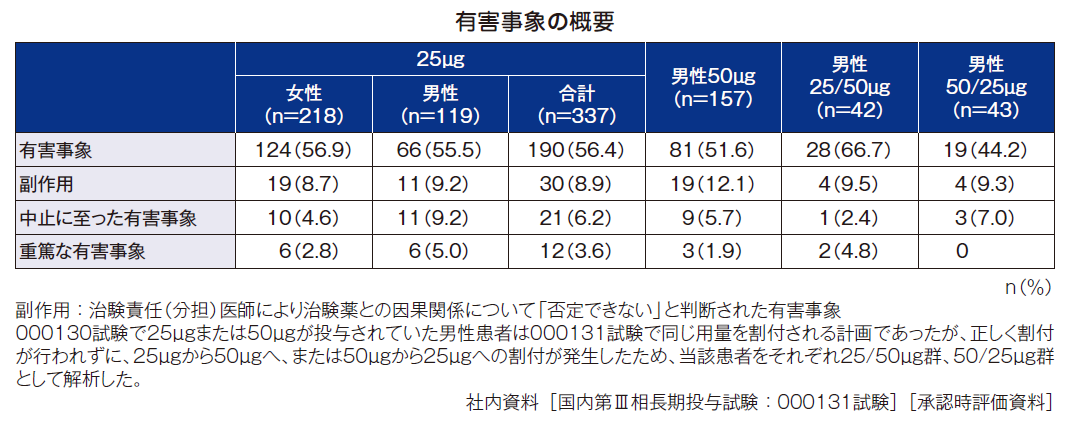
安全性[主要評価項目](併合安全性解析対象集団)
1. 有害事象の発現割合
本試験における有害事象の発現割合は、ミニリンメルト®50μg群51.6%(81/157例)、25μg群56.4%(190/337例)[男性55.5%(66/119例)、女性56.9%(124/218例)]、25/50μg群66.7%(28/42例)、50/25μg群44.2%(19/43例)、プラセボ群(女性を含む)24.2%(52/215例)であった。
重篤な有害事象はミニリンメルト®50μg群で1.9%(3例)、25μg群で3.6%(12例)[女性2.8%(6例)、男性5.0%(6例)]及び25/50μg群で4.8%(2例)に認められた。内訳は50μg群で低ナトリウム血症が2例、麻痺性イレウスが1例、25μg群では橈骨骨折及び乳癌がそれぞれ2例(いずれも女性)、硬膜下血腫、膀胱瘤(いずれも女性)、膵癌、尺骨骨折、直腸癌、末梢動脈閉塞性疾患、冠動脈硬化症、前立腺炎(いずれも男性)、がそれぞれ1例、25/50μg群に心房粗動、細菌性胃腸炎がそれぞれ1例であり、そのうち50μg群の低ナトリウム血症2例及び25/50μg群の心房粗動1例は治験薬との因果関係が否定されなかった。また、この他に25/50μg群で、最終投与確認日の4日後に自殺既遂による死亡例を1例認めたが、因果関係は否定された。
中止に至った有害事象はミニリンメルト®50μg群で低ナトリウム血症が3例、血中ナトリウム減少が2例、下痢、麻痺性イレウス、肝機能異常、BNP増加がそれぞれ1例、25μg群でBNP増加が5例(男性4例、女性1例)、乳癌(女性)及び前立腺炎(男性)がそれぞれ2例、冠動脈硬化症、肝機能異常、血中ナトリウム減少、血中カルシウム減少、膵癌(いずれも男性)、耳鳴、疲労、橈骨骨折、体重増加、低ナトリウム血症、傾眠、膀胱瘤(いずれも女性)がそれぞれ1例に発現した。25/50μg群で尿管結石症が1例、50/25μg群でBNP増加、BNP異常、傾眠がそれぞれ1例に発現した。
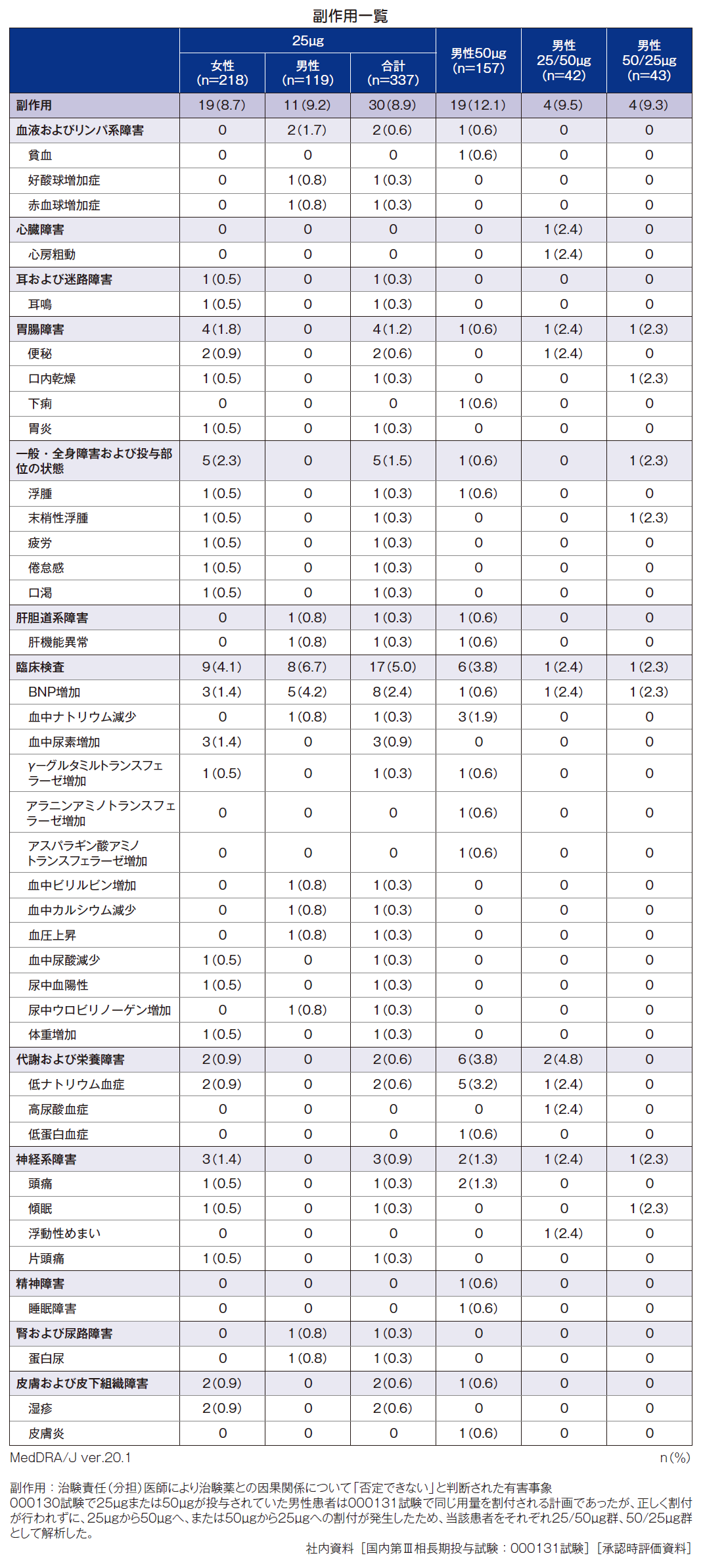
2. 副作用発現割合と主な副作用
本試験の副作用発現割合は、ミニリンメルト®50μg群12.1%(19/157例)、25μg群8.9%(30/337例)[女性8.7%(19/218例)、男性9.2%(11/119例)]、25/50μg群9.5%(4/42例)、50/25μg群9.3%(4/43例)、プラセボ群(女性を含む)5.1%(11/215例)であった。
主な副作用は、ミニリンメルト®50μg群で低ナトリウム血症が3.2%(5例)、血中ナトリウム減少が1.9%(3例)、頭痛が1.3%(2例)、25μg群でBNP増加が2.4%(8例)[女性1.4%(3例)、男性4.2%(5例)]、血中尿素増加が0.9%(3例:女性のみ)、便秘、低ナトリウム血症、湿疹がそれぞれ0.6%(2例:女性のみ)、25/50μg群で心房粗動、便秘、BNP増加、低ナトリウム血症、高尿酸血症、浮動性めまいがそれぞれ2.4%(1例)、50/25μg群で口内乾燥、末梢性浮腫、BNP増加、傾眠がそれぞれ2.3%(1例)であった。
4. 効能又は効果 男性における夜間多尿による夜間頻尿
6. 用法及び用量 成人男性には、通常、1日1回就寝前にデスモプレシンとして50μgを経口投与する。
7. 用法及び用量に関連する注意(抜粋)
7.1 年齢、体重、血清ナトリウム値、心機能等の状態から低ナトリウム血症を発現しやすいと考えられる場合には、デスモプレシンとして25μgから投与を開始することを考慮すること。
7.3 投与開始後8週から12週を目安に、症状の改善が認められない場合には、本剤の投与中止を考慮すること。
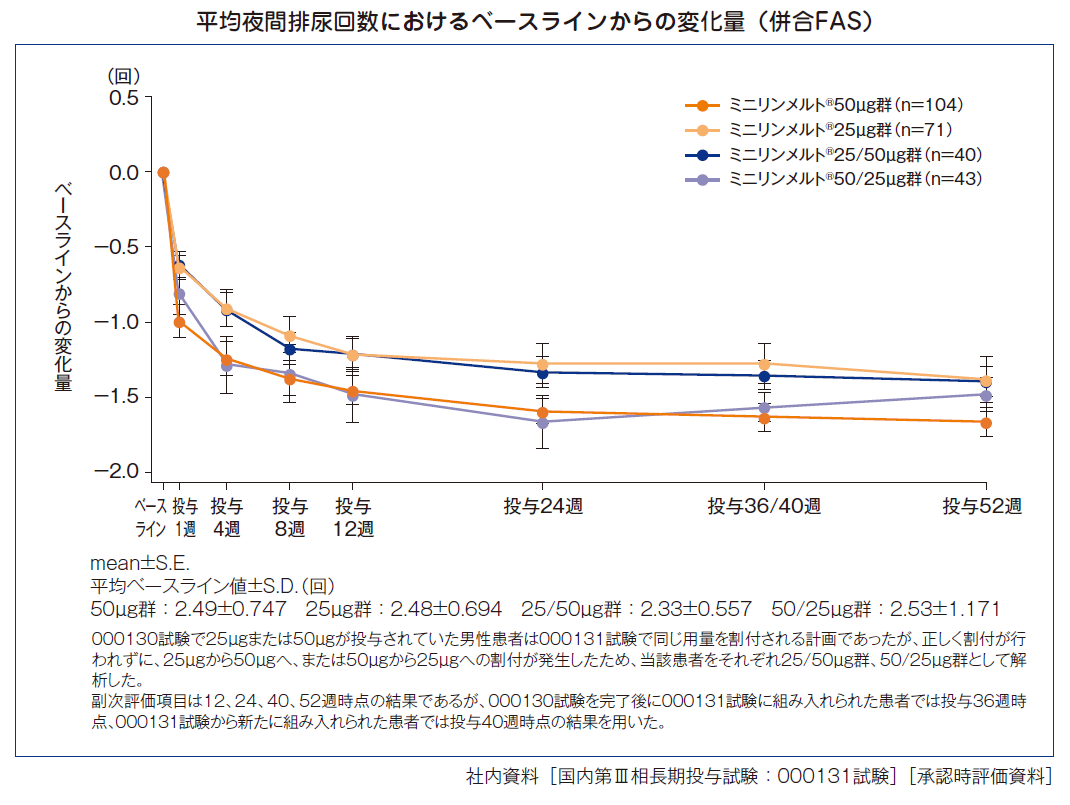
平均夜間排尿回数におけるベースラインからの変化量(男性)[副次評価項目]
投与後52週時点の平均夜間排尿回数におけるベースラインからの変化量は、ミニリンメルト®50μg群−1.67回、25μg群−1.39回、25/50μg群−1.40回、50/25μg群−1.49回であった。
また、投与後52週時点での平均夜間排尿回数は50μg群0.73回、25μg群1.13回、25/50μg群0.93回、50/25μg群0.96回であった。
女性患者の有効性のデータは承認外のため削除しました。
6. 用法及び用量 成人男性には、通常、1日1回就寝前にデスモプレシンとして50μgを経口投与する。
7. 用法及び用量に関連する注意(抜粋)
7.1 年齢、体重、血清ナトリウム値、心機能等の状態から低ナトリウム血症を発現しやすいと考えられる場合には、デスモプレシンとして25μgから投与を開始することを考慮すること。
7.3 投与開始後8週から12週を目安に、症状の改善が認められない場合は、本剤の投与中止を考慮すること。
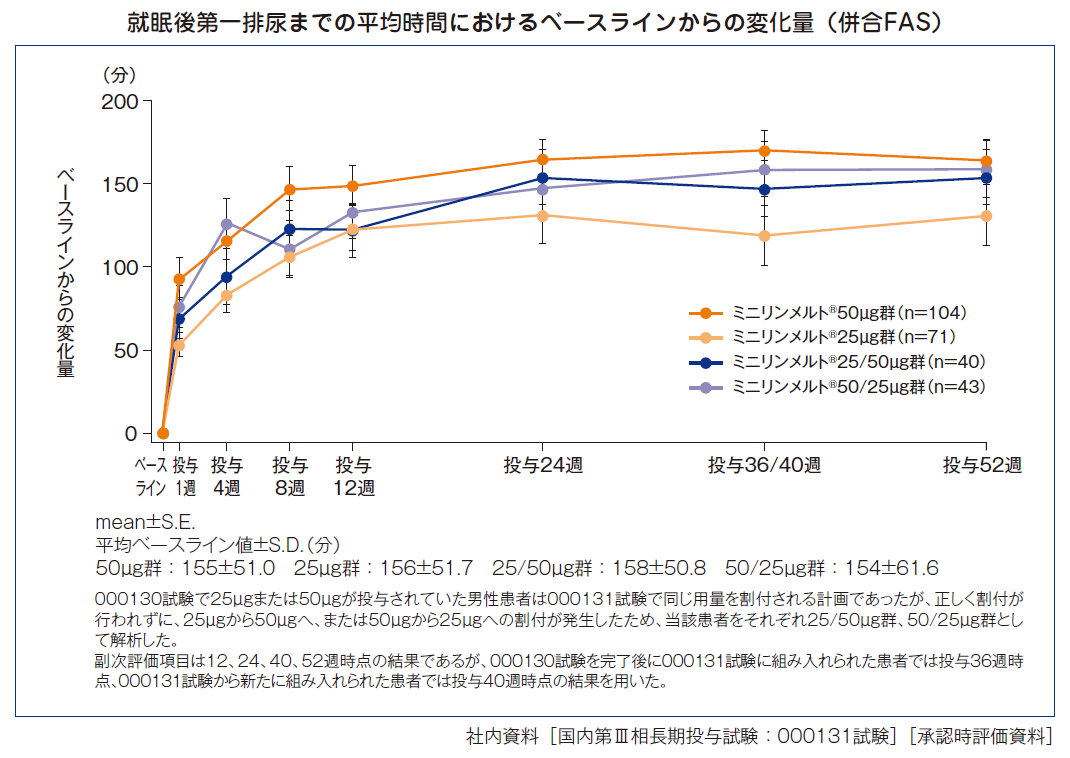
就眠後第一排尿までの平均時間におけるベースラインからの変化量(男性)[副次評価項目]
投与後52週時点の就眠後第一排尿までの平均時間におけるベースラインからの変化量は、ミニリンメルト®50μg群164分、25μg群131分、25/50μg群154分、50/25μg群159分であった。
女性患者の有効性のデータは承認外のため削除しました。
6. 用法及び用量 成人男性には、通常、1日1回就寝前にデスモプレシンとして50μgを経口投与する。
7. 用法及び用量に関連する注意(抜粋)
7.1 年齢、体重、血清ナトリウム値、心機能等の状態から低ナトリウム血症を発現しやすいと考えられる場合には、デスモプレシンとして25μgから投与を開始することを考慮すること。
7.3 投与開始後8週から12週を目安に、症状の改善が認められない場合は、本剤の投与中止を考慮すること。
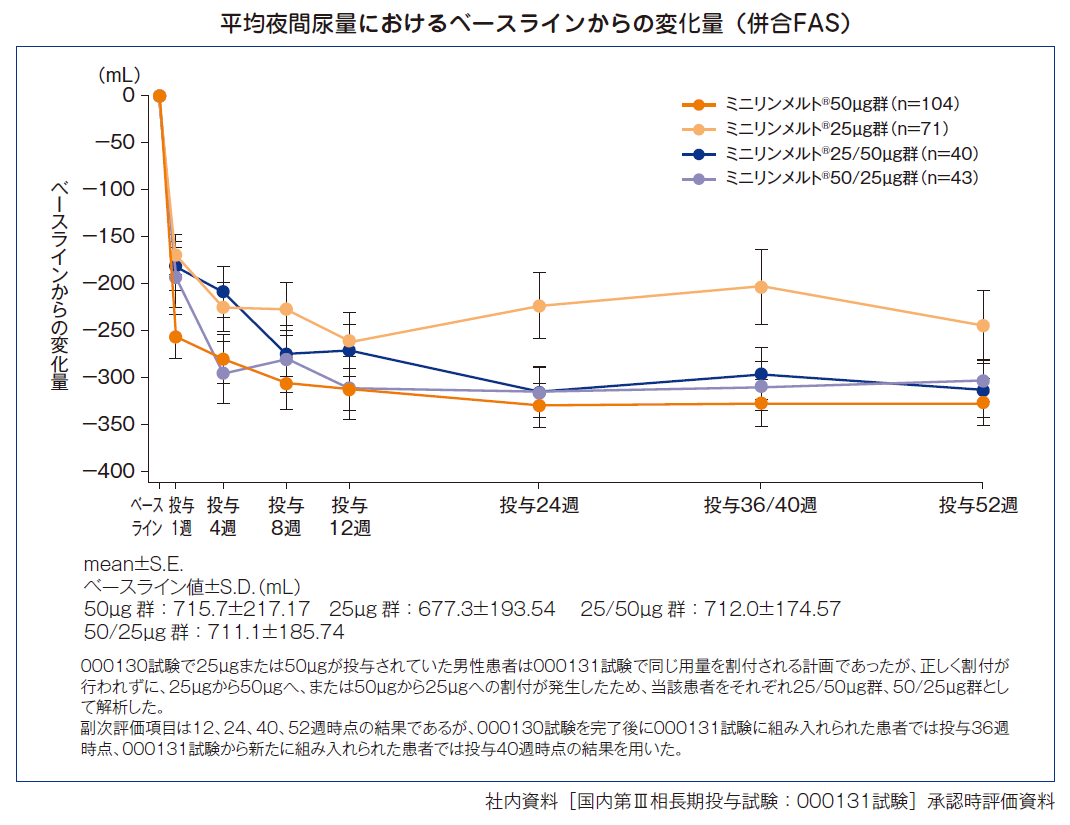
平均夜間尿量におけるベースラインからの変化量(男性)[副次評価項目]
投与後52週時点の平均夜間尿量におけるベースラインからの変化量は、ミニリンメルト®50μg群−326.7mL、25μg群−244.8mL、25/50μg群−314.1mL、50/25μg群−303.5mLであった。
女性患者の有効性のデータは承認外のため削除しました。
6. 用法及び用量 成人男性には、通常、1日1回就寝前にデスモプレシンとして50μgを経口投与する。
7. 用法及び用量に関連する注意(抜粋)
7.1 年齢、体重、血清ナトリウム値、心機能等の状態から低ナトリウム血症を発現しやすいと考えられる場合には、デスモプレシンとして25μgから投与を開始することを考慮すること。
7.3 投与開始後8週から12週を目安に、症状の改善が認められない場合は、本剤の投与中止を考慮すること。
1)社内資料[国内第Ⅲ相長期投与試験:000131試験][承認時評価資料]

 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。 は、
は、 会員登録がお済みでない方
会員登録がお済みでない方