 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。サイト内には、生殖医療領域、泌尿器腫瘍領域、夜間頻尿領域、夜尿症領域等、ご覧になりたい領域の情報を、わかり易く掲載しております。
 は、
は、 に会員登録することでご利用いただけます。
に会員登録することでご利用いただけます。
一般の方および日本国外の医療関係者への情報提供を目的としたものではありませんのでご了承ください。
 は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。
は、フェリング・ファーマ株式会社が提供する、医療関係者向け 領域専用サイトの総称です。 は、
は、 に会員登録することでご利用いただけます。
に会員登録することでご利用いただけます。
日本人健康成人にミニリンメルト60、120、240μg(各6例)を水負荷条件下で単回経口投与したときのデスモプレシンの血漿中濃度推移は下図のとおりでした(ミニリンメルトは水を用いずに舌下で溶解して投与)。
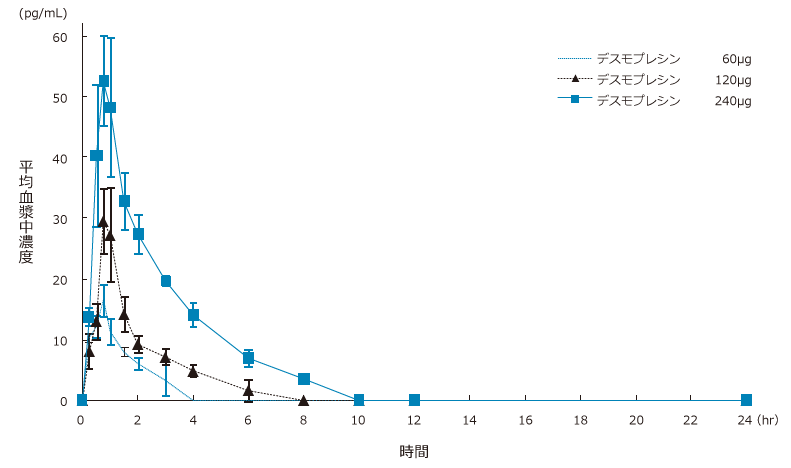 平均±標準偏差(n=6)
平均±標準偏差(n=6)
また、薬物動態パラメータは表のとおりであり、投与量60、120、240μgでは用量に応じたAUC及びCmaxの増加が認められました。
| パラメータ | 60μg | 120μg | 240μg |
|---|---|---|---|
| AUCt(pg・hr/mL) | 23.25±4.48 | 50.84±7.46 | 139.90±10.99 |
| AUCint(pg・hr/mL) | 35.61±9.01 | 61.95±9.96 | 150.24±14.17 |
| Cmax(pg/mL) | 16.57±2.52 | 3.26±1.46 | 56.80±8.80 |
| Tmax(hr) | 0.71±0.10 | 0.88±0.14 | 0.79±0.19 |
| T1/2(hr) | 1.63±0.56 | 2.13±0.66 | 2.00±0.15 |
日本人健康成人(16例)にミニリンメルト120μgをクロスオーバー法にて空腹時及び食後に経口投与したとき、平均AUCtは44.94及び12.03pg・hr/mL、平均Cmaxは14.89及び3.90pg/mLでした(ミニリンメルトは水を用いずに舌下で溶解して投与)。
デスモプレシン2μg静脈内単回投与時のPKに対する腎機能障害の影響を腎機能(クレアチニンクリアランス)に基づき、被験者を腎機能正常(>80mL/分)、腎機能障害が軽度(50~80mL/分)、中等度(30~49mL/分)及び高度(5~29mL/分)の4群に層別し検討したところ、腎機能障害の重症度に応じて全身クリアランスが低下し、中等度及び高度の腎機能障害患者では正常者と比較して統計学的な有意差が認められました(p<0.05、ANOVA)。正常者のAUCは186.1±64.1pg・hr/mL(平均±標準偏差)でしたが、軽度、中等度及び高度の腎機能障害患者では、それぞれ280.8±31.7、453.3±174.7及び681.5±226.1pg・hr/mLに増加し、中等度及び高度の腎機能障害患者では正常者に比し統計学的に有意な差が認められました(p<0.05、ANOVA)。分布相の半減期(t1/2λ1)は腎機能障害の程度に影響されませんでした。一方、消失相の半減期(t1/2λ1)は、正常者で3.7時間であったのに対し、軽度、中等度及び高度の腎機能障害被験者ではそれぞれ4.8、7.2及び10.0時間に延長しました。
ラットに125Iで標識したデスモプレシン酢酸塩水和物0.2μgを鼻腔内投与し、30分後に放射能濃度を測定したところ、血液(血漿)を除き、甲状腺>膀胱>腎臓>肝臓の順での分布が認められました。甲状腺に高濃度な放射性分布が観察されたことから、脱離した125Iが移行しているものと考えられます。
| 添加濃度(pg/mL) | 2 | 50 | 100 |
|---|---|---|---|
| 血清蛋白結合率(%) | 76.3±3.3 | 74.2±2.8 | 74.0±3.4 |
ヒト腎臓及び肝臓ミクロソームを用いてデスモプレシンの代謝を検討した試験では、デスモプレシンの代謝は認められませんでした7)。 一方、ラット腎臓及び肝臓の粗ホモジネートを用いて検討した試験では、肝臓の粗ホモジネートでインキュベートした場合にデスモプレシンの分解がみられましたが、 腎臓の粗ホモジネート中での分解は少なく、デスモプレシンのエンドペプチダーゼによる代謝はミクロソームではなく、肝細胞内で生じていることが示唆されました。 デスモプレシン酢酸塩水和物をウサギ腸管粘膜ホモジネートとインキュベートした場合には、 代謝物として[Mpa1, des-D-Arg8-Gly9-NH2]-バソプレシンがHPLCで確認され、 それ以外の分解物は検出されませんでした8)。デスモプレシンはおそらくプロリルエンドペプチダーゼによりそのC-末端で代謝を受けて、加水分解されると推測されます。
チトクロームP450(CYP)に対するデスモプレシンの阻害作用についてヒト肝ミクロソームを用いて検討した結果、デスモプレシンは10μMの濃度で、試験に用いたCYP分子種 (CYP1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1及び3A4)に対し阻害作用を示しませんでした。
外国人の健康成人男性24例にデスモプレシン経口製剤200、400、800μg(普通錠:日本未承認)を単回投与したところ、クリアランスは7.6(L/hr)でした。
外国人の健康成人6例にデスモプレシン酢酸塩2μgを静脈内投与したところ、尿中未変化体排泄率は52.4±6.6%(平均±標準偏差)でした。